一种元素提供最外层电子形成正离子的能力表现在它提供给原子的能量足以把电子从原子中夺走。这种能量被称为电离作用能量.简单地说,电离能是供应给孤立的原子或分子的能量,敲除其最松散的价电子形成一个正离子。它的单位是电子伏的电动车或kJ/mol,在放电管中测量,在放电管中一个快速移动的电子与一个气体元素碰撞并喷射出其中一个电子。电离能(IE)越小,形成阳离子的能力就越好。
这可以用波尔原子模型,因为它考虑的是一个类氢原子,其中一个电子由于columbic引力围绕一个带正电荷的原子核旋转,电子只能有固定的或量子化的能级。玻尔模型电子的能量被量子化,给出如下:
式中,Z为原子序数,n为主量子数,n为整数。对于氢原子,电离能是13.6eV。
电离能(eV)是使电子从n = 1(基态或最稳定态)到无穷远所需要的能量。因此,取无穷远处的0 (eV)参考值,电离能可写成: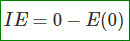
例如,第一个电离能钠(Na)的含量为:
它的第二个电离能是
因此,即2>即1(电动汽车)。如果有K个电离数,这也是正确的,那么IE1<即2<即3...........<即k
金属的电离能较低。低电离能意味着该元素具有较好的电导率。例如,银(Ag,原子序数Z = 47)的电导率为6.30 × 107s/m,其电离能为7.575 eV,铜(Cu, Z = 29)的电离能为5.76 × 107s/m,电离能为7.726 eV。在导体低电离能使电子穿过带正电荷的晶格,形成电子云。
影响电离能的因素
在元素周期表中,总的趋势是电离能从左到右增加,从上到下减少。因此,影响电离能的因素可归纳如下:
- 原子的大小:电离能随着原子的大小而减小,因为随着原子半径的增大,原子核与最外层电子之间的哥伦布引力减小,反之亦然。
- 屏蔽效应:内壳层电子的存在屏蔽或减弱了原子核和价电子之间的引力。因此电离能减少。内层电子的数量意味着更多的屏蔽。然而,就金而言,即使金的体积大于银,其电离能也大于银。这是由于在金的情况下,内部的d和f轨道提供了弱屏蔽。
- 核电荷:核电荷越多,由于原子核和电子之间的吸引力越大,原子就越难以电离。
- 电子配置:原子的电子构型越稳定,收回一个电子就越困难,因此电离能也就越大。















对我的考试很有用
别担心,布瓦娜。祝你考试好运!